Tuyển chọn vi khuẩn ưa mặn sinh tổng hợp polyhydroxyalkanoate (PHA) phân lập từ đảo Trường Sa Lớn
MTXD – Tóm tắt- Polyhydroxyalkanoate (PHA) là loại nhựa sinh học có khả năng phân hủy sinh học do các vi sinh vật sinh ra. PHA là một dạng dự trữ năng lượng và C trong tế bào vi sinh vật ở điều kiện môi trường dư thừa nguồn C và thiếu một trong số các hợp chất N, S, P,... Có rất nhiều vi sinh vật sinh tổng hợp PHA nhưng các vi khuẩn ưa mặn có ưu thế vượt trội do tiết kiệm được chi phí và năng lượng trong quá trình nuôi cấy và thu hồi PHA[3, 7]. Nghiên cứu này trình bày các kết quả phân lập và tuyển chọn vi khuẩn ưa mặn có khả năng sinh tổng hợp PHA từ đảo Trường Sa Lớn. Hai mươi chủng đã được phân lập, trong đó, có 2 chủng vi khuẩn ưa mặn có khả năng sinh tổng hợp PHA nhiều hơn được lựa chọn để định danh bằng giải trình tự đoạn gen 16S rRNA. Kết quả phân tích cho thấy chủng TSLT14 thuộc chi Klebsiella và được đặt tên là Klebsiella sp.
TSLT14 với mã số trên GenBank là MZ165335. Chủng TSLS23 thuộc chi Bacillus và được đặt tên là Bacillus sp. TSLS23 với mã số MZ165340.
Từ khóa: Phân hủy sinh học; Bioplastic; Polyhydroxyankanoate; Ưa mặn; Trường Sa.
1. Đặt vấn đề
Polyhydroxyalkanoate (PHA) là một loại nhựa có nguồn gốc sinh học và có khả năng phân hủy sinh học cả ở điều kiện hiếu khí, kị khí, trong đất, nước ngọt và nước mặn [2, 6, 8, 10]. PHA là một dạng dự trữ nguồn C và năng lượng của vi sinh vật khi điều kiện môi trường mất cân bằng, dư thừa nguồn C và thiếu một trong các nguồn N, P, S,... Khi môi trường thiếu hụt nguồn C, vi sinh vật lại sử dụng các hạt PHA cho sinh trưởng. Các vi sinh vật có khả năng sinh tổng hợp PHA thuộc nhiều nhóm khác nhau, bao gồm cả vi khuẩn Gram dương, Gram âm, vi khuẩn thông thường và nhóm vi khuẩn cực trị trong đó có nhóm vi khuẩn ưa mặn [3]. Các vi khuẩn ưa mặn sinh PHA đã được công bố nhiều trên thế giới, chúng thuộc các chi như Halomonas, Halococcus,... [3, 6, 8]. Các PHA do các vi khuẩn ưa mặn sinh ra thường là các PHA mạch ngắn hoặc trung bình. Các vi khuẩn ưa mặn có khả năng sinh PHA có thể được ứng dụng trong công nghiệp do chúng có thể sinh trưởng ở nồng độ muối cao (> 10%) khi mà hầu hết các vi sinh vật không thể sinh trưởng được. Do đó, khi lên men để thu PHA có thể không cần khử trùng môi trường và thiết bị nuôi cấy nên tiết kiệm được năng lượng. Ngoài ra, các vi sinh vật ưa mặn sinh PHA có khả năng sử dụng nhiều nguồn cơ chất rẻ tiền là phụ phế phẩm nông nghiệp nên sẽ tiết kiệm chi phí. Một yếu tố nữa có thể làm giảm giá thành PHA tạo thành trong công nghiệp là việc tách chiết và thu hồi PHA từ các vi sinh vật ưa mặn sinh trưởng với nồng độ muối trên 10% có thể sử dụng nước cất hay nước máy để làm phá vỡ tế bào thay vì việc sử dụng dung môi [3, 8].
Trên thế giới, các nghiên cứu về nhóm các vi sinh vật ưa mặn sinh tổng hợp PHA đã được nghiên cứu khá nhiều, như Bacillus megaterium, (Gram dương), Halomonas TD01, Haloferax mediterannei, Halococcus morrhuae, Halomonas boliviensis, Pseudomonas sp. CT13 (Gram âm). Đây là các chi có khả năng sinh PHA lên tới 50% và chịu mặn tới 15% [4, 7, 8]. Tuy nhiên, các nghiên cứu này ở Việt Nam mới chỉ là các nghiên cứu cơ bản. Nghiên cứu của Trần Hữu Phong đánh giá khả năng sinh tổng hợp PHA của các chủng vi khuẩn Yangia sp. ND199 phân lập từ đất rừng ngập mặn ở Nam Định (nơi có độ mặn thấp) [7]. Nghiên cứu của Hoàng Thị Lan Anh phân lập được vi khuẩn ưa mặn Halomonas maura cũng ở rừng ngập mặn Giao Thủy Nam Định. Đặc biệt, chưa có nghiên cứu chi tiết nào về khả năng sinh tổng hợp PHA của các chủng vi sinh vật phân lập từ đảo Trường Sa Lớn (Việt Nam) để ứng dụng cho bộ đội đóng quân trên biển, đảo.
Trong nghiên cứu này, các vi sinh vật ưa mặn từ đảo Trường Sa Lớn có khả năng sinh tổng hợp PHA được phân lập, tuyển chọn. Các chủng cũng được định danh bằng phương pháp giải trình tự đoạn gen 16S rRNA.
2. Vật liệu và phương pháp
2.1. Vật liệu, thiết bị, hóa chất
2.1.1. Vật liệu
Các mẫu đất, nước và chất thải nuôi heo lấy từ đảo Trường Sa Lớn (như bảng 1). Các mẫu được lấy theo TCVN 7538-6:2010 (ISO 10381-6:2009). Mẫu được đựng vào các túi nilon vô trùng, bọc kín, bảo quản lạnh đến khi sử dụng. Chi tiết vị trí lấy mẫu được tổng hợp theo bảng dưới đây.
Bảng 1. Vị trí các mẫu đất mẫu dùng trong nghiên cứu.

2.1.2. Thiết bị
Box cấy vô trùng, máy lắc, máy ly tâm, tủ hút, tủ sấy, nồi khử trùng hơi nước, cân phân tích, máy PCR (BioRad), thiết bị điện di ngang và hệ thống chụp ảnh điện di Geldox (Biorad) và các dụng cụ thí nghiệm khác của Phòng Công nghệ Hóa sinh/Viện Công nghệ mới.
2.1.3. Hóa chất
Các dung môi dùng để tách chiết PHA: Acetone, ethanol, methanol, NaClO, nước cất. Các hóa chất dùng để nuôi cấy vi sinh vật như thành phần môi trường nuôi cấy. Các hóa chất đảm bảo độ tinh khiết phân tích PA.
Thành phần môi trường nuôi cấy (g/l): MgSO4.7H2O 0,25; NaCl 50; CaCl2.2H2O 0,09; KCl 0,5; KBr 0,06; pepton 5; Cao nấm men 10; Glucose 10; pH 7-7,2. Môi trường được khử trùng ở 115 oC trong 30 phút. Môi trường thạch được bổ sung 18 g/l agar.
2.2. Phương pháp
2.2.1. Phân lập vi khuẩn ưa mặn tổng hợp PHA [5]
Mẫu nước: Lắc đều mẫu, lấy 50, 100 l mẫu nước gạt đều trên thạch đĩa chứa môi trường nuôi cấy, ủ ấm 37 oC trong 72 giờ để kiểm tra sự phát triển của khuẩn lạc.
Mẫu đất, mẫu chất thải, nước thải nuôi heo: Cân 10 g đất/chất thải/nước thải lắc đều trong 100 ml nước muối sinh lý, sau đó, pha loãng ở các nồng độ theo dãy thập phân. Lấy 100 l mẫu đã pha loãng cấy gạt trên thạch đĩa chứa môi trường nuôi cấy, ủ ấm 37 oC trong 72 giờ để kiểm tra sự phát triển của khuẩn lạc.
Pha môi trường chứa Nile red: Môi trường thạch được đun nóng chảy, bổ sung Nile red đến nồng độ cuối cùng 0,5 mg/l sau đó đổ ra các đĩa, để nguội và cấy các vi khuẩn lên. Khi vi khuẩn phát triển thành khuẩn lạc thì soi dưới đèn UV để phát hiện các vi khuẩn sinh PHA (khuẩn lạc phát sáng màu cam hoặc hồng).
2.2.2. Tuyển chọn các chủng vi khuẩn
Sau khi phân lập được các vi khuẩn có khả năng sinh tổng hợp PHA, các chủng được nuôi cấy trên môi trường dinh dưỡng. Sau 48 - 72 giờ, các mẫu được lấy ra ly tâm thu sinh khối và tách chiết thu hồi PHA theo mục 2.2.3. Mẫu nào thu được hàm lượng PHA cao sẽ được tuyển chọn cho các nghiên cứu tiếp theo. Các thí nghiệm được lặp lại 3 lần.
2.2.3. Tách chiết thu hồi PHA [1]
Mỗi mẫu lấy 1,5 ml dịch nuôi cấy vào ống eppendoft đã biết khối lượng. Ly tâm loại bỏ dịch thu sinh khối và sấy khô, cân khôi lượng để tính hàm lượng tế bào khô.
Tách chiết và thu hồi PHA được thực hiện theo quy trình mô tả trước đây, sử dụng metanol để kết tủa PHA [1]. Các thí nghiệm được lặp lại 3 lần. Cân lại khối lượng và tính khối lượng PHA thu được (g/l) theo công thức:
Hàm lượng PHA hoặc hàm lượng sinh khối
(g/l) = msau − mban đầu(g)
V (lít)
Trong đó: m ban đầu là khối lượng ống eppendoft hay ống falon ban đầu; msau là khối lượng ống sau khi sấy khô sinh khối hoặc PHA; V là thể tích mẫu lấy để phân tích.
Tỷ lệ PHA (%) = m PHA (g/l) ∗ 100 m sinh khối (g/l)
2.2.4. Định danh vi sinh vật [7]
Các chủng thu được hàm lượng PHA cao được định danh bằng giải trình tự 16S rRNA. Các chủng vi khuẩn được nuôi cấy trên đĩa thạch để tạo các khuẩn lạc riêng rẽ. Từ các khuẩn lạc, sinh khối vi khuẩn được lấy để tách ADN tổng số theo kit Genomic DNA Extraction. ADN tổng số thu được được kiểm tra bằng điện di trên gel agarose 1% trong đệm TAE 1X. Các đoạn AND tổng số đủ điều kiện được sử dụng làm khuôn để nhân đoạn gen 16S rRNA. Thành phần phản ứng PCR (l): ADN tổng số 1; Buffer 2,5; Tag polymerase 1, dNTP 2,5, Primer 27f/1492r 1/1; dH2O 16. Phản ứng PCR được thực hiện theo quy trình 35 chu kỳ như mô tả trước đây [7]. Các sản phẩm PCR được làm sạch và được giải trình tự trên thiết bị iSeq100 (Illumina). Các trình tự nucleotide hoàn chỉnh được so sánh với ngân hàng dữ liệu gen của NCBI bằng cách sử dụng công cụ BLAST.
3. Kết quả và thảo luận
3.1. Kết quả phân lập vi sinh vật ưa mặn sinh tổng hợp PHA
Từ 6 mẫu nước, đất và chất thải nuôi heo ngoài đảoTrường Sa Lớn, có 20 chủng vi sinh vật đã được phần lập có khả năng sinh tổng hợp PHA trong đó có 4 chủng nấm sợi (TSM1, TSM2, TSM3, TSM4). Tuy nhiên, thời gian nuôi cấy nấm sợi để thu sinh khối lâu hơn nên chúng tôi lựa chọn các chủng vi khuẩn để nghiên cứu tiếp.
Kết quả cho thấy khi cấy trên môi trường có bổ sung Nile red và soi dưới đèn UV, các chủng vi sinh vật sinh tổng hợp PHA có phát sáng màu hồng hoặc cam với mức độ khác nhau (hình 1).
Theo Ratnaningrum 2018, mức độ phát sáng dưới đèn UV cũng thể hiện mức độ sinh tổng hợp PHA [5]. Kết quả phân lập cho thấy các chủng có khả năng sinh tổng hợp PHA với các mức độ khác nhau, phát sáng màu hồng hoặc cam nhạt. Tuy nhiên, đây chỉ là nghiên cứu định tính khả năng sinh tổng hợp PHA. Các chủng này sẽ được nghiên cứu định lượng về khả năng sinh PHA để chọn ra các chủng sinh tổng hợp PHA nhiều nhất.

3.2. Tuyển chọn các chủng có khả năng sinh tổng hợp PHA cao
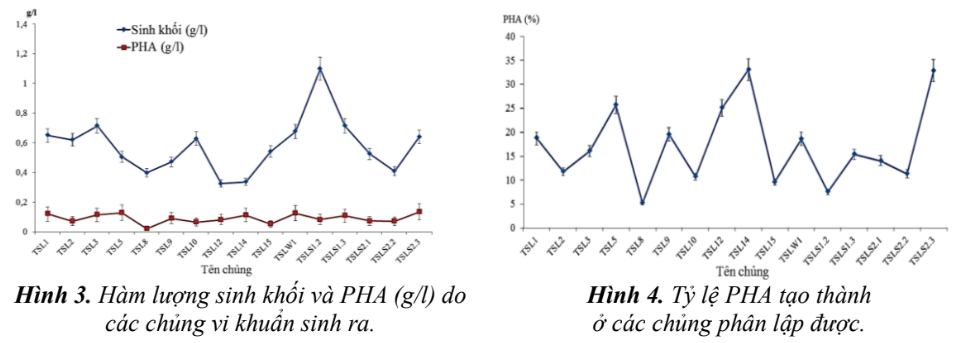
Cấy các chủng vi khuẩn phân lập được trên môi trường dinh dưỡng như mục 2.1.3. Sau 48 giờ, dịch nuôi cấy được ly tâm thu sinh khối và tách chiết thu hồi PHA. Lượng sinh khối và hàm lượng PHA thu được được trình bày trên hình 3, hình 4.
Từ kết quả hình 3, hình 4 cho thấy hầu hết các vi khuẩn đều có khả năng sinh PHA với các mức độ khác nhau, từ 2,47% đến 33,66% so với lượng tế bào khô. Các chủng TSL10, TSLS1.2 có
hàm lượng sinh khối cao nhưng hàm lượng PHA (g/l) lại thấp hơn nên tỷ lệ % PHA thu được thấp. Các chủng TSL1, TSL3, TSL5, TSL9, TSL12, TSLT14, TSLW1, TSLS1.3, TSLS23 có khả năng sinh PHA cao hơn so với các chủng còn lại. Tuy nhiên, chỉ có 2 chủng TSLT14 và TSLS23 có tỷ lệ % PHA thu được cao nhất (khoảng 30%) nên 2 chủng này được sử dụng để định tên, phân loại cho các nghiên cứu tiếp theo. Đây là những khảo sát ban đầu về khả năng sinh tổng hợp PHA của các chủng vi sinh vật bản địa ở đảo Trường Sa Lớn. Để nâng cao hiệu suất tạo thành PHA của các chủng cần nghiên cứu các điều kiện môi trường ảnh hưởng đến sinh trưởng (nguồn C, nguồn N, nhiệt độ nuôi cấy, pH môi trường, nồng độ muối cũng như tỷ lệ C/N), các điều kiện lên men tối ưu để thu nhận được lượng sinh khối và PHA nhiều nhất. So với các chủng tự nhiên phân lập được thuộc chi như Bacillus sp. B58, B51, B60, Bacillus cereus B52, Bacillus thuriengensis... cũng có khả năng sinh tổng hợp PHA với hàm lượng dao động từ 20 đến 35% [5].
3.3. Định danh vi khuẩn
Kết quả giải trình tự và so sánh trình tự trên ngân hàng gen cho thấy chủng TSLT14 thuộc chi Klebsiella, có trình tự 16S rRNA tương đồng 100% với các chủng Klebsiella pneumoniae OU17, Klebsiella quasipneumoniae SNI47, NCTC11357. Chủng này được đặt tên là Klebsiella sp. TSLT14. 130 N. T. T. Thư, ..., P. K. Cường, “Tuyển chọn vi khuẩn ưa mặn ... từ đảo Trường Sa Lớn.”
Chủng TSLS23 thuộc chi Bacillus, có trình tự đoạn gen 16S rRNA tương đồng 100% với các
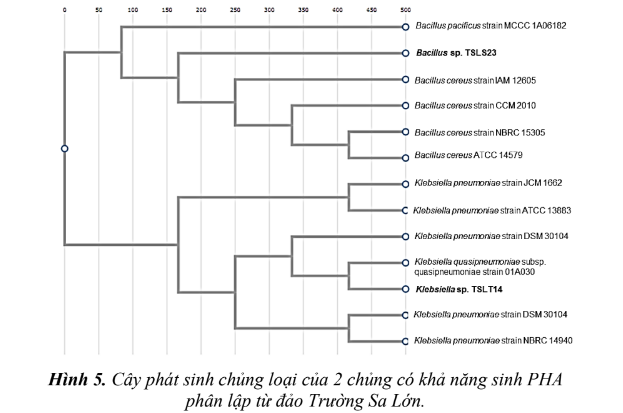
chủng Bacillus aureus G1-1, MLY1, tương đồng 99,88% với chủng Bacillus thuringiensis GA- A07. Chủng này được đặt tên là Bacillus sp. TSLS23. Trên thế giới, đã có một số công bố về khả năng sinh PHA của các chủng thuộc chi Klebsiella và Bacillus. Chủng vi khuẩn Klebsiella aerogenes có khả năng sinh PHB nhanh hơn chủng E. Coli tái tổ hợp [11]. Chủng vi khuẩn Klebsiella pneumoniae có khả năng phát triển tốt trên môi trường chứa glucose, dầu thực vật đã sử dụng và dầu ăn với các tỷ lệ khác nhau. Chủng này cũng sinh PHA tốt hơn chủng Bacillus cereus và tương đương với Bacillus subtilis [9]. Đây cũng là các chi có khả nặng chịu mặn tốt, chịu mặn đến 5% [4, 7]. 6 trong số 19 chủng vi khuẩn có khả năng sinh tổng hợp PHA phân lập từ đất cũng thuộc chi Bacillus [5]. Trình tự đoạn gen 16S rRNA của hai chủng này đã được đăng ký trên GenBank với mã số đăng ký cho 2 chủng TSLT14 và TSLS23 lần lượt là MZ165335 và MZ165340. Cây phát sinh chủng loại của 2 chủng phân lập được và các chủng gần gũi trình bày ở hình 5.
4. Kết luận
Nghiên cứu này đã phân lập được 20 chủng có khả năng sinh tổng hợp PHA ở các mức độ khác nhau. Trong số đó, chủng TSLT14 được phân lập từ nước thải chăn nuôi ở đảo Trường Sa Lớn thuộc chi Klebsiella và đặt tên là Klebsiella sp. TSLT14. Chủng TSLS23 phân lập từ đất ngoài đảo Trường Sa Lớn thuộc chi Bacillus và được đặt tên là Bacillus sp. TSLS23. Trình tự 16S rRNA đã được đăng ký trên GenBank với mã số đăng ký cho 2 chủng TSLT14 và TSLS23 lần lượt là MZ165335 và MZ165340.
Kiến nghị: Để nâng cao hiệu suất tạo thành PHA, cần nghiên cứu các yếu tố ảnh hưởng đến sinh trưởng và khả năng tạo ra PHA của các chủng như nguồn C, nguồn N, tỷ lệ C/N, nồng độ muối, nhiệt độ nuôi cấy và quy trình lên men để thu nhận PHA được tốt nhất.
Lời cảm ơn: Bài báo được hoàn thành với sự hỗ trợ kinh phí của đề tài cấp Viện KH-CN quân sự năm 2021: “Nghiên cứu chế tạo nhựa sinh học (bioplastic) có khả năng tự phân hủy trong môi trường biển đảo”.
NGUYỄN THỊ TÂM THƯ*
, LÊ HUY HOÀNG, BÙI THỊ THU HÀ,
NGUYỄN LÂM HÀ, PHẠM KIÊN CƯỜNG
Tài liệu tham khảo
[1]. Ali WS, Zaki NH, “Production of bioplastic by bacteria isolated from lcal soil and organic wastes”. Current Research in Microbiology and Biotechnology, 5(2), pp. 1012-1017, (2017).
[2]. Dilkes-Hoffman LS, Lant PA, Laycock B, Pratt S. “The rate of biodegradation of PHA bioplastics in the marine environment: A meta-study”. Marine Pollution Bulletin 142, pp. 15-24, (2019).
[3]. Koller M. “Production of Hydroxylankanoate (PHA) biopolyesters by extremophiles?” MOJ Polymer Science, I (2), pp. 69-85, (2017).
[4]. Mitra R, Xu T, Xiang H, Han J, “Current developments on polyhydroxyalkanoates synthesis by using halophlies as a promising cell factory”. Microbial Cell Factories 19:86. https://doi.org/10.1186/s12934-020-01342-z, (2020).
[5]. Ratnaningrum D, Saraswaty V, Priatni S, Lisdiyanti P, Purnomo A, Pudjiraharti S. “Screening of polyhydroxyalkanoates (PHA)-producing bacteria from soil bacteria strains”. IOP Conf. Series: Earth and Environmental Science 277 (2019) 012003 IOP Publishing. DOI:10.1088/1755-1315/277 /1/012003, (2018).
[6]. Saharan BS, Grewal A, Kumar P. “Biotechnological production of polyhydroxyankanoates: a review on trends and latest developments”. Chinese Journal of Biology, Article ID 802984, 18 pages. http://dx.doi.org/10.1155/2014/802984, (2014).
[7]. Trần Hữu Phong, “Nghiên cứu lên men và thu nhận polyhydroxyalkanoates từ vi khuẩn phân lập ở một số vùng đất của Việt Nam”. Luận án Tiến sĩ sinh học. Đại học Quốc gia Hà Nội, (2017).
[8]. Thomas T, Sudesh K, Bazire A, Elain A, Tan HT, Lim H, Bruzaud S. “PHA production and PHA
synthases of the Halophilic bacterium Halomonas sp”. SF2003. Bioengineering, 7, 29. DOI:10.3390. www.mdpi.com/journal/bioenginee-ring, (2020).
[9]. Tufail S, Munir S, Jamil N. “Variation analysis of bacterial polyhydroxyalkanoate production using saturated and unsaturated hydrocarbons”. Brazilian Journal of Microbiology, pp. 48, 629 - 636, (2017).
[10].Winnacker M. “Polyhydroxyalkanoates: Recent advances in their synthesis and application”. European Journal Lipid Science Technology. DOI: 10.1002/ejlst.201900101, (2019).
[11].Zhang H, Obias V, Gonyer K, Dennis D. “Production of polyhydroxyalkanoates in Succrose-utilizing recombinant Escherichia coli and Klebsiella strains”. Apply Environment Mirobiology 60, pp. 198- 1205, (1994).
ABSTRACT
Screening of polyhydroxyalkanoate (PHA) produced by bacteria isolated from Truong Sa Lon island
Polyhydroxyalkanoate (PHA) is a biodegradable plastic produced by microorganisms.PHA is a form of energy and C storage in microbial cells in the conditions of excess Csource and lack of one of the compounds N, S, P, etc. Many microorganisms canbiosynthesis PHA but halophilic bacteria have some advantages due to cost and energysavings. In this study, the results of isolation and screening of halophilic bacteria fromsoils, wastes, and water on Truong Sa Lon island are presented. Two strains of 20 strainsof halophilic bacteria isolated from Truong Sa Lon island which are capable ofbiosynthesis of high PHA were identified by sequencing 16S rRNA gene segment. Theresults showed that strain TSLT14 belonged to the genus Klebsiella and was namedKlebsiella sp. TSLT14. TSLS23 strain belongs to the genus Bacillus and was namedBacillus sp.
TSLS23.Keywords: Biodegradation; Bioplastic; Polyhydroxyankanoate; Halophilic; Truong Sa.
*Viện Công nghệ mới, Viện Khoa học và Công nghệ quân sự.
*Email: thu.n3t.cnm@gmail.com
Các tin khác
Thủ tướng Chính phủ yêu cầu khẩn trương ứng phó bão số 3
MTXD - Thủ tướng Chính phủ Phạm Minh Chính vừa ký ban hành Công điện số 86/CĐ-TTg ngày 3-9-2024 chỉ đạo các bộ ngành, địa phương khẩn trương triển khai ứng phó bão số 3 năm 2024.
TP.HCM: Trao danh hiệu Doanh nghiệp Xanh năm 2024
MTXD - Ngày 29/8/2024, Hiệp hội Doanh nghiệp TP.HCM và Báo Sài Gòn Giải Phóng, tổ chức Lễ trao danh hiệu “Doanh nghiệp xanh TP.HCM năm 2024”. Đây là hoạt động hướng đến Diễn đàn kinh tế thành phố lần thứ 5 diễn ra từ 24/9/2024 đến 27/9/2024.
Huyện Hải Lăng ( Quảng Trị) : Lập biên bản yêu cầu công ty CP Thiên Tân giảm thiểu ô nhiễm môi trường
Ngày 20/8/2024, Ban QLDA, PTQĐ&CCN huyện Hải Lăng tổ chức làm việc với Công ty cổ phần Thiên Tân về việc tập kết sản phẩm ống cống không đúng nơi quy định; xe vận chuyển nguyên, vật liệu gây ra bụi; xe có trọng lượng lớn gây sụt lún điểm đấu nối giữa Quốc lộ 1A với tuyến đường quy hoạch RD-2 Cụm côn
Quảng Nam: Nhiều trường học dọn dẹp môi trường chuẩn bị năm học mới.
MTXD - Những ngày trước khai trường, nhiều trường học ở các địa phương tỉnh Quang Nam đã tổ chức cho học sinh đến nhận lớp, dọn vệ sinh, chuẩn bị khai giảng năm học mới.
Huyện Buôn Đôn (Đắk Lắk): Chỉ đạo kiểm tra hoạt động đốt than của các hộ dân
MTXD - Chủ tịch UBND huyện Buôn Đôn ( Đắk Lắk ) vừa chỉ đạo, UBND xã Ea Bar kiểm tra, xử lý thông tin phản ánh của người dân về hoạt động đốt lò than tự phát gây ô nhiễm môi trường.










